UNIVERSE:国際共同第Ⅲ相試験
承認時評価資料、McCrindle BW et al. J Am Heart Assoc 2021;10:e021765、COI: 本研究はバイエルの資金により行われた。
試験デザイン
目的
Fontan手術後4ヵ月以内の機能的単心室症を有する小児患者(2~8歳)を対象に、イグザレルトの薬物動態と薬力学を検討すること(パートA)及び、イグザレルトの安全性と有効性をアスピリンと比較検討すること(パートB)

1)
試験組入れ前4ヵ月以内にFontan手術を受けた機能的単心室症を有する患者
2)
パートAの患者はパートBに登録しなかった。パートAの初期12日間の薬物動態・薬力学・安全性を評価した後に、パートBの無作為割付けを開始した。
3)
非日本人成人にイグザレルト10mgを1日1回投与時の曝露量(定常状態における投与0時間から24時間までのAUC)に相当するよう、生理学的薬物速度論モデルを用いた予測に基づいて体重(7kg以上30kg未満)で調整した用量。患者の体重増加による用量調整は、6ヵ月時点で実施した。
4)
アスピリンの用量は1日最大81mg又は100mgとした。アスピリン81mg又は100mgはFontan手術施行後における血栓・塞栓形成の抑制としては本邦未承認。国内承認効能・効果は、「狭心症、心筋梗塞、虚血性脳血管障害における血栓・塞栓形成の抑制」、「CABGあるいはPTCA施行後における血栓・塞栓形成の抑制」および「川崎病」。
評価項目
有効性主要評価項目:血栓性イベント(静脈又は動脈)
安全性主要評価項目:重大な出血(ISTH基準)
安全性副次評価項目:重大ではないが臨床的に問題となる出血、軽微な出血
その他の安全性評価項目:有害事象、臨床検査(血液学的検査、血液生化学検査、PT、aPTT)など
その他の評価項目:薬物動態、薬力学
解析計画
有効性主要評価項目の解析は、パートAに組入れ及びパートBで無作為割付けされた患者のうち、少なくとも1回治験薬の投与を受けた患者を対象とし、治験薬の初回投与から投与終了までの期間におけるデータに基づき、発現割合を算出した。
安全性の解析は、有効性解析対象集団と同様の集団を対象とした。安全性主要及び副次評価項目について、治験薬の初回投与から投与終了後2日目までの期間における発現割合を算出した。「重大な出血」及び「重大ではないが臨床的に問題となる出血」について、群別に発現割合を算出した。
事前に規定したサブグループ解析として、年齢、性別、人種、民族、地域、ベースラインのeGFR、体重、前治療(抗血小板/抗凝固療法)等を実施した。
判定基準
血栓性イベント(静脈又は動脈)、出血事象は中央独立判定委員会(CIAC)が盲検下で評価した。
血栓性イベント(静脈又は動脈)は、定期検査又は臨床画像検査で認められる心臓血管内の新たな血栓像の出現、又は血栓との強い関連が明らかな臨床イベントの発現(心原性脳塞栓症、肺塞栓症など)と定義した。
重大な出血は、2g/dL以上のヘモグロビン量の低下を伴う出血、成人において2単位以上の輸血(濃厚赤血球又は全血)が必要な出血、重要な臓器における出血、死因となった出血とした。
重大ではないが臨床的に問題となる出血は、重大な出血の定義を満たさないが、医学的な介入、予定外の来院又は電話による問診や治験薬の投与中止(中断)を必要とする、痛みなどの不快な症状を伴う、あるいは日常生活に支障を来す明らかな出血とした。
軽微な出血は、重大な出血及び重大ではないが臨床的に問題となる出血事象の基準を満たさないその他の臨床的に明らかな出血とした。
選択基準および除外基準
主な選択基準
・
試験への組入れ前4ヵ月以内に最初のFontan手術を完了している2~8歳の機能的単心室症を有する患者
主な除外基準
・
本試験のスクリーニング期間中に、血栓症を示す所見が確認された患者
(Fontan手術後の経胸壁心エコー又は他の画像診断により確認された無症候性のものを含む)
・
臨床的に意味のある吸収障害に関連した消化器疾患の病歴又は手術歴がある患者
・
タンパク漏出性胃腸症の病歴、又はその徴候/症状がある患者
・
活動性の出血又は高い出血リスクがあり、抗血小板又は抗凝固療法が禁忌となる患者
・
本試験以外で抗凝固又は抗血小板療法が適応となる患者
・
スクリーニング時の血小板数が50×109/L未満の患者
・
eGFR30mL/min/1.73m2未満の患者
・
臨床的に重大な肝疾患が既知である患者(スクリーニング時に肝硬変、急性肝炎、慢性活動性肝炎、又はALTがULNの3倍超かつ総ビリルビンがULNの1.5倍超で、うち20%超が直接ビリルビン)
eGFR:推算糸球体ろ過量、ALT:アラニンアミノトランスフェラーゼ、ULN:基準値上限
患者背景①

n(%)または平均値±標準偏差
組入れられた全症例(*:n=65、**:n=64)
患者背景①
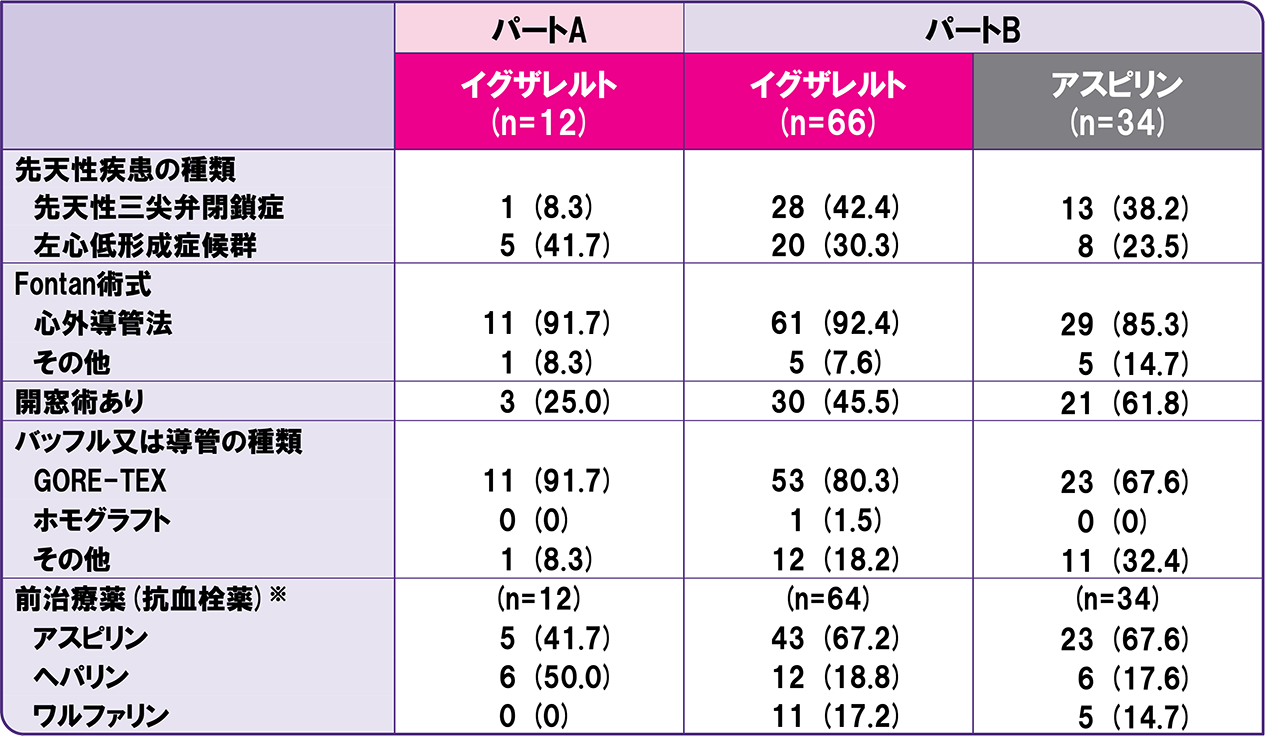
n(%)
組入れられた全症例(※:安全性解析対象集団)
有効性主要評価項目

有効性解析対象集団/治験薬の初回投与から投与終了まで
※
パートBについて算出。NA: 0例又は1例の場合、信頼区間は算出せず。
安全性評価項目①
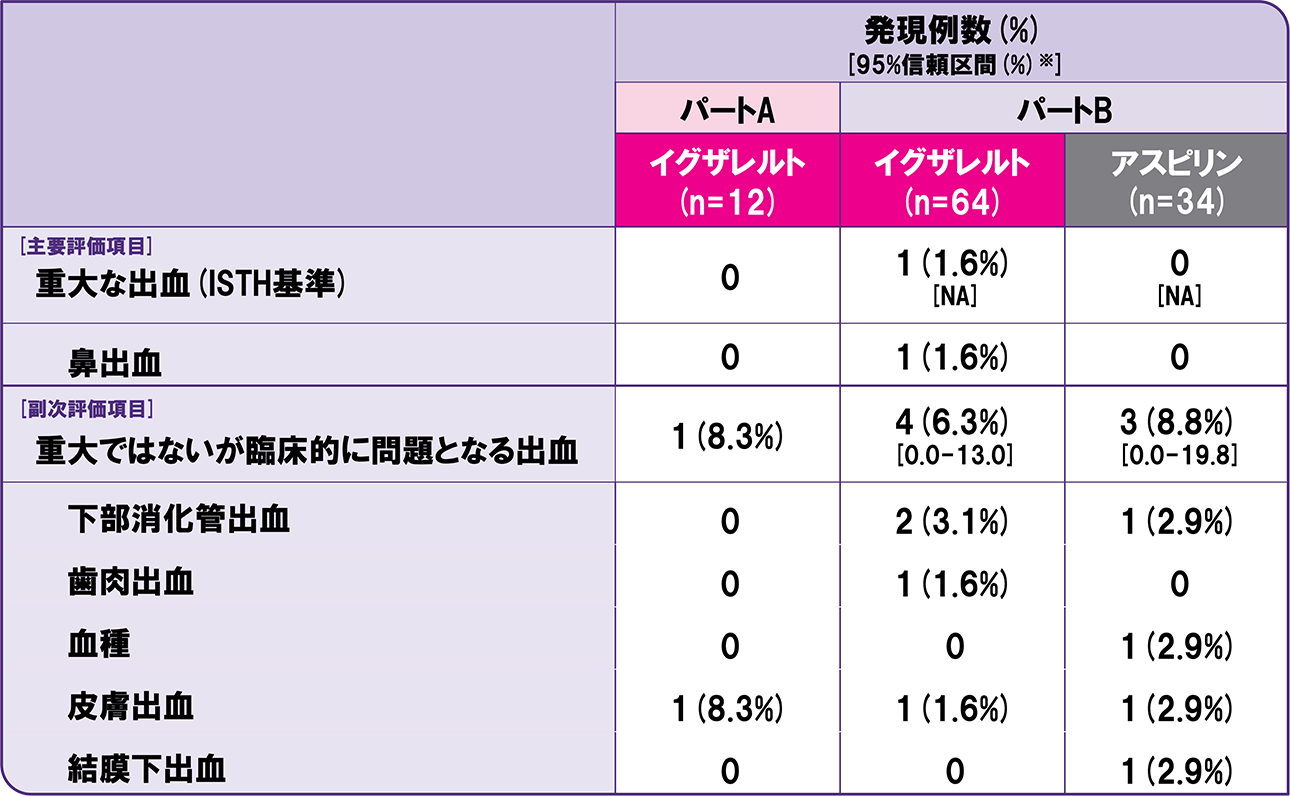
安全性解析対象集団/治験薬の初回投与から投与終了後2日目まで
※
パートBの重大な出血および重大ではないが臨床的に問題となる出血について算出。NA: 0例又は1例の場合、信頼区間は算出せず。
安全性評価項目②

安全性解析対象集団/治験薬の初回投与から投与終了後2日目まで
日本人における有効性・安全性
有効性主要評価項目

有効性解析対象集団/治験薬の初回投与から投与終了まで
安全性主要評価項目

安全性解析対象集団/治験薬の初回投与から投与終了後2日目まで
承認時評価資料
副作用
全体集団(パートA/Bの合計)
・
副作用は、イグザレルト群76例中23例(30.3%)、アスピリン群34例中9例(26.5%)に認められた。
・
主な副作用は、イグザレルト群で斑状出血6例(7.9%)、鼻出血3例(3.9%)、血腫3例(3.9%)、アスピリン群で斑状出血4例(11.8%)等であった。
・
重篤な副作用は、イグザレルト群で出血性ショック1例、アスピリン群では認められなかった。
・
投与中止に至った副作用は、イグザレルト群で出血性ショック1例、アスピリン群では認められなかった。
・
死亡に至った副作用は、イグザレルト群、アスピリン群ともに認められなかった。
日本人集団(パートB)
・
副作用は、イグザレルト群8例中4例に発現し、その内訳は皮下血腫2例、血中ビリルビン増加1例、鼻出血1例、紫斑1例、出血性ショック1例であった。
・
イグザレルト群において、重篤な副作用および投与中止に至った副作用は出血性ショック1例、死亡に至った副作用は認められなかった。
・
アスピリン群では副作用の発現は認められなかった。
治験薬投与下(治験薬投与終了後2日目まで)
まとめ
日本人を含むFontan手術後の機能的単心室症の小児患者を対象とした国際共同第Ⅲ相試験UNIVERSEにおいて、イグザレルトの安全性及び有効性を検討した。
有効性主要評価項目である血栓性イベント(静脈又は動脈)は、パートBのイグザレルト群1例(1.6%)、アスピリン群3例(8.8%)に発現した。
安全性主要評価項目である重大な出血(ISTH基準)は、パートBのイグザレルト群1例(1.6%)に発現し、アスピリン群では認められなかった。
※
薬物動態と薬力学の検討を主目的としたパートA(イグザレルト)における血栓性イベント(静脈又は動脈)は1例(8.3%)に発現し、重大な出血(ISTH基準)は認められなかった。
UNIVERSEにおける副作用の発現状況は『副作用』のスライドを、その他の安全性情報は電子添文の副作用及び臨床成績の安全性の結果をご参照ください。







